Tình hình sản xuất và tiêu thụ
Thuốc đầu tay trong các phác đồ điều trị đái tháo đường là metformin. Khi thất bại với đơn trị liệu thì người ta sử dụng phối hợp với các nhóm khác. Tuy nhiên, các nhóm khác hoặc gây tác dụng hạ đường huyết quá mức có thể dẫn đến biến chứng như co giật, động kinh, mất ý thức, đôi khi dẫn đến tử vong hoặc gây tăng cân,… Năm 2005, thuốc trị đái tháo đường theo cơ chế mới được ra đời với biệt dược là Januvia chứa sitagliptin, đã mang lại nhiều lợi ích cho bệnh nhân là không gây tác dụng phụ hạ đường huyết quá mức và không gây tăng cân, nên được đưa vào điều trị rộng rãi, có thể dùng đơn lẻ hoặc kết hợp với metformin.
Sitagliptin phối hợp với metformin hydroclorid cho hiệu quả kiểm soát đường huyết với mức giảm HbA1c có ý nghĩa. Tuy nhiên, nhược điểm của metformin hydroclorid là có thời gian bán thải ngắn (3-4 giờ), sinh khả dụng thấp (50%) gây bất tiện khi phải dùng thuốc nhiều lần trong ngày. Ngược lại, sitagliptin có thời gian bán thải dài (12,6 giờ). Do đó, việc bào chế kết hợp thuốc metformin hydroclorid PTKD và sitagliptin PTTT là giải pháp giúp kiểm soát đường huyết ổn định cả ngày, giảm tác dụng phụ không mong muốn; giúp đáp ứng nhu cầu điều trị đảm bảo tuân trị của bệnh nhân.
Hiện tại, trong nước chưa có công bố bào chế thành công, cũng như chưa có chế phẩm nào trên thị trường chứa đồng thời metformin hydroclorid 500 mg PTKD và sitagliptin 50 mg PTTT. Thuốc chứa sitagliptin tại thị trường Việt Nam mới chỉ có thuốc biệt dược gốc với giá thành khá cao. Việc phát triển và ứng dụng quy trình sản xuất thuốc chứa hai hoạt chất này cho phép tạo ra thuốc sản xuất trong nước với giá thành phù hợp, đáp ứng nhu cầu cao và đa dạng của điều trị, thay thế thuốc ngoại nhập.
Quy trình và phương pháp thực hiện
Quy trình sản xuất viên 2 lớp bao phim chứa metformin hydroclorid 500 mg PTKD và sitagliptin 50 mg PTTT
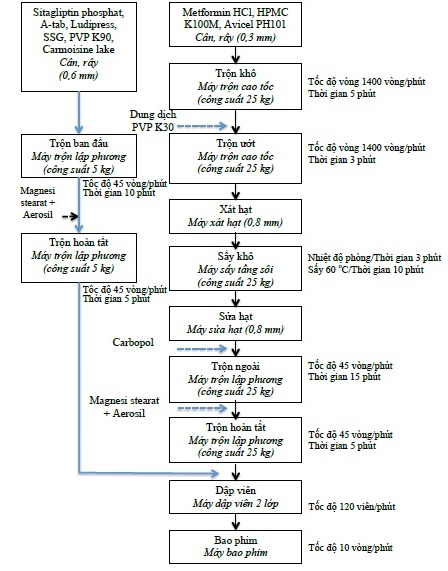
Mô tả quy trình:
1. Chuẩn bị cốm lớp metformin hydroclorid
+ Pha chế tá dược dính: phối hợp 480g ethanol 96% và 140g nước cất trong thùng thép không gỉ, khuấy đều bằng homomixer với tốc độ 1.000 vòng/phút, thêm từ từ 600g povidon K30 vào, tiếp tục khuấy khoảng 30 phút cho tan hoàn toàn, thu được dung dịch tá dược dính.
+ Trộn bột khô: rây các nguyên liệu qua rây 0,3 mm. Cân các thành phần hydroxypropyl methylcellulose K100M, microcrystalline cellulose 101, metformin hydroclorid theo công thức. Cho lần lượt vào máy trộn siêu tốc: 680g microcrystalline cellulose 101; 2460g hydroxypropyl methylcellulose K100M; 5.000g metformin hydroclorid. Trộn khô trong 8 phút với tốc độ cánh ngang 500 vòng/phút, tốc độ cánh đứng 1.400 vòng/phút, thu được khối bột đồng nhất.
+ Trộn bột ướt: tiếp tục vận hành máy trộn siêu tốc với tốc độ cánh ngang 500 vòng/phút và tốc độ cánh đứng 1.400 vòng/phút. Thêm dung dịch tá dược dính vào với tốc độ khoảng 500 mL/phút, tiếp tục trộn ướt trong khoảng 3 phút.
+ Xát hạt ướt, tạo hạt: đổ liên tục khối cốm ướt qua máy xát hạt xoay tròn, lưới 0,8 mm. Chuyển phần cốm xát được vào máy sấy tầng sôi. Bật chế độ thổi gió mát đuổi hơi cồn trong 3 phút. Sấy cốm bằng máy sấy tầng sôi: nhiệt độ khí vào 600C, nhiệt độ khối hạt 40-450C, tốc độ quạt gió 2.800 vòng/phút, tần suất giũ lọc 5 lần/phút. Thời gian sấy 10 phút. Kiểm tra độ ẩm cốm sau sấy đạt 2%-5%. Sửa hạt qua lưới 0,8 mm.
+ Trộn hoàn tất: cân cốm sau khi sửa. Tính toán colloid silicon dioxid, magnesi stearat, carbopol phù hợp với lượng cốm thu được. Cân các tá dược colloid silicon dioxid, magnesi stearat, carbopol cho vào thùng trộn đã có sẵn cốm. Vận hành thùng trộn tốc độ 45 vòng/phút, trộn trong 15 phút.
2. Chuẩn bị bột thuốc chứa sitagliptin
+ Trộn bột khô: rây các nguyên liệu qua rây 0,6 mm. Cân các thành phần sitagliptin phosphat, ludipress, natri starch glycolat, povidon K90 và dicalci phosphate, carmoisin lake theo công thức. Cho lần lượt vào máy trộn lập phương: 642,5g sitagliptin phosphat, 500g ludipress, 150g natri starch glycolat, 300g povidon K90, 3,5g carmoisin lake và 1.377,5g dicalci phosphat. Trộn trong 10 phút với tốc độ trộn 45 vòng/phút, thu được khối bột đồng nhất.
+ Giai đoạn trộn hoàn tất: tiếp tục cho 5g colloid silicon dioxid, 25g magnesi stearat vào thùng trộn. Trộn tốc độ 45 vòng/phút, trộn trong 5 phút, thu được khối bột đồng nhất.
3. Dập viên
Chuẩn bị máy dập viên 2 lớp. Sử dụng chày caplet (chiều dài viên 19 mm, chiều rộng viên 11 mm), hai mặt lồi. Cho cốm lớp metformin hydroclorid vào phễu 1. Cho bột lớp sitagliptin vào phễu 2. Chỉnh tốc độ máy 12 viên/phút. Vận hành máy, chỉnh hình thành viên cho lớp metformin hydroclorid, sau đó chỉnh lớp metformin hydroclorid đạt khối lượng trung bình theo công thức. Chỉnh máy để độ cứng của lớp metformin hydroclorid đạt khoảng 70N. Tiến hành dập viên 2 lớp, chỉnh khối lượng lớp sitagliptin đạt khối lượng trung bình lớp sitagliptin theo công thức. Chỉnh máy để độ cứng của viên 2 lớp đạt khoảng 180N.
Trong quá trình dập viên, kiểm tra các chỉ tiêu:
- Khối lượng viên: mỗi lần thử 10 viên, 10 phút/lần kiểm. Kiểm tra khối lượng toàn viên bằng cách dùng mũi mác tách 2 lớp và kiểm tra khối lượng từng lớp. Khối lượng này không được khác biệt KLTB (khối lượng trung bình) khoảng 3%. Chỉnh máy để khối lượng từng lớp về KLTB.
- Độ cứng viên: 150-210N. Mỗi lần thử 10 viên. Các thời điểm lấy mẫu: đầu lô, giữa lô, cuối lô.
- Độ mài mòn: yêu cầu độ mài mòn < 1%. Mỗi lần thử 10 viên. Các thời điểm lấy mẫu: đầu lô, giữa lô, cuối lô.
4. Bao phim
+ Pha dịch bao: cho 9.846 ml nước và 4.614 ml ethanol 96% vào bình chứa, tiến hành khuấy với cánh khuấy mái chèo (tốc độ 150 vòng/phút), cho từ từ 923,9g Opadry II Pink vào, khuấy trong 20 phút. Dịch bao phim được khuấy trong suốt quá trình bao.
+ Tiến hành bao: cho viên vào nồi bao phim. Sấy viên ở nhiệt độ 60-700C, tốc độ nồi 10 vòng/phút, trong 10 phút. Phun dịch bao tốc độ 30 g/phút (đầu súng phun cách bề mặt viên 17 cm), áp suất khí nén 1,5 Pa. Sấy khô viên sau khi bao ở 500C/30 phút.
+ Đánh giá thành phẩm: hình thức cảm quan, độ cứng, đồng đều khối lượng, độ hòa tan.
5. Đóng lọ
Đóng lọ 28 viên bao phim, trong lọ có túi hút ẩm và lọ được ép màng trước khi đậy nắp. Dán nhãn.
Ưu điểm của công nghệ, hiệu quả kinh tế
Quy trình đã được áp dụng bào chế 3 lô ở quy mô 10.000 viên/lô. Quy trình đạt độ ổn định, có thể sản xuất sản phẩm có chất lượng đồng đều và đạt tiêu chuẩn quy định.
Thuốc thành phẩm đạt độ ổn định sau 12 tháng, trong điều kiện dài hạn, và 6 tháng trong điều kiện cấp tốc; Các nhà khoa học đã xây dựng tiêu chuẩn chất lượng sản phẩm, với các chỉ tiêu cơ bản (hình thức cảm quan, độ đồng đều hàm lượng, định tính, định lượng, giới hạn tạp chất, và độ hòa tan) và phương pháp kiểm nghiệm đã được thẩm định đầy đủ theo hướng dẫn của ICH (Hiệp hội đồng thuận quốc tế). Tiêu chuẩn này cũng được Viện Kiểm nghiệm thuốc Trung ương thẩm định, đưa vào áp dụng để phân tích, kiểm nghiệm các mẫu thuốc nghiên cứu.
Quy trình có thể áp dụng cho các công ty sản xuất thuốc có dây chuyền sản xuất viên nén bao phim đạt tiêu chuẩn GMP-WHO. Chi phí sản xuất 100.000 viên là 250 triệu đồng. Dự kiến giá bán 9.000đồng/viên. Việc sản xuất trong nước giúp đáp ứng nhu cầu thuốc điều trị bệnh đái đường là 899.034 viên có chứa sitagliptin và 76.751.283 viên có chứa metformin (theo kết quả trúng thầu năm 2020 được công bố trên trang web của Cục quản lý dược – Bộ Y tế) tại Việt Nam mỗi năm.
Thông tin liên hệ chuyên gia, hỗ trợ
1. ThS. Nguyễn Ngọc Nhã Thảo
ĐT: 0902 903 844. Email: nnnthao@ctump.edu.vn
2. Trung tâm Khoa học Công nghệ Dược Sài Gòn (Sapharcen)
Địa chỉ: 41 Đinh Tiên Hoàng, quận 1, TP.HCM. Điện thoại: 02838 295 641.
Lam Vân (CESTI)